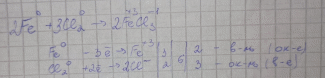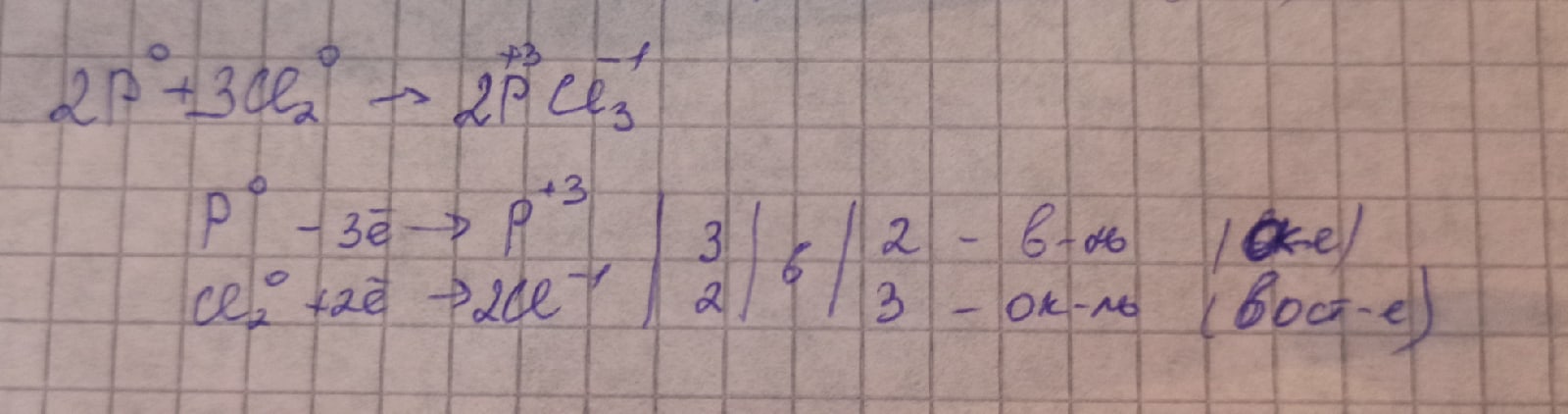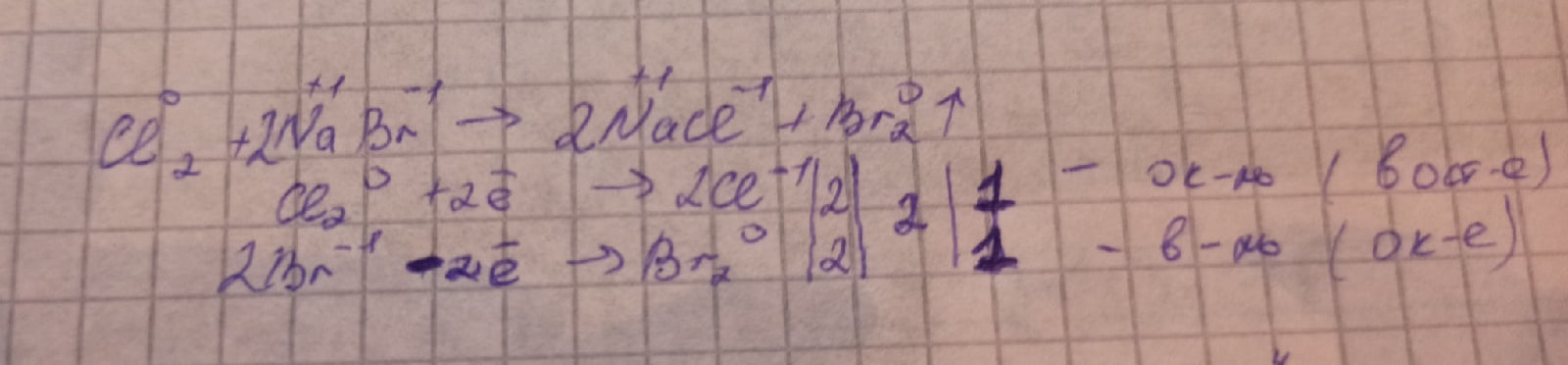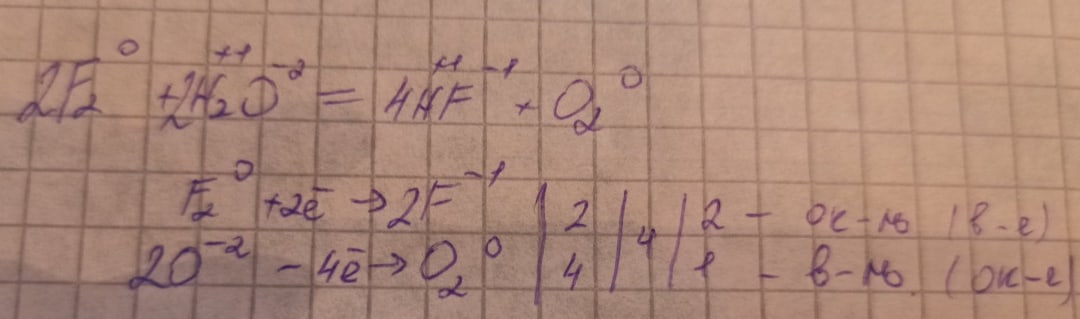Тема урока: Химические свойства галогенов
Цели урока:
1.образовательные: способствовать формированию знаний о химических свойствах галогенов, развивать умения составлять уравнения окислительно-восстановительных реакций (ОВР).
2. развивающие: создавать условия для формирования навыков строить рассуждения, обобщать и делать выводы.
3.воспитательные: создавать условия для формирования навыков устной и письменной речи, способствовать развитию навыков коммуникативного общения учащихся.
Методы обучения: словесные (рассказ, объяснение, беседа); иллюстративные; проблемно-поисковый.
Тип урока: урок изучения и первичного закрепления новых знаний.
ХОД УРОКА
I. Организационный момент.
- Здравствуйте, рада вас видеть готовыми к уроку. Давайте отметим отсутствующих.
II. Актуализация знаний
-На прошлом уроке мы начали изучать галогены. Что мы узнали на прошлом уроке?
(строение атомов галогенов, получении и применении, физические свойства)
-Какими еще свойствами обладают галогены? (химическими свойствами)
-Верно, тема нашего сегодняшнего урока «Химические свойства галогенов».
III. Этап усвоения новых знаний
1) Галогены взаимодействуют с металлами
-Фтор при нагревании реагирует со всеми металлами, включая золото и платину, на холоде взаимодействует с щелочными металлами, свинцом и железом. Хлор, бром и йод при обычных условиях реагируют со щелочными металлами, а при нагревании – с медью, железом и оловом.
В результате взаимодействия образуются галогениды, которые являются солями.
- Давайте рассмотрим взаимодействие хлора с железом.
- От чего это зависит степень окисления железа в соединении? (В зависимости от участника ракции - окислителя, степень окисления железа в продуктах реакции может быть равна +2 или +3)
-Хлор является сильным окислителем? (да)
-Тогда железо, под действием этого сильного окислителя отдаст 2 электрона или 3? (три)
-Какая степень окисления у железа в этом соединении? (три) Какая формула образовавшегося вещества?(FeCl3)
Желающие к доске…
(1 ученик пишет на доске, остальные у себя в тетради)
- 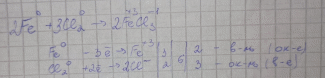
- Какие свойства проявляют галогены в данной реакии? (окислительные)
2) Взаимодействие галогенов с неметаллами.
А) Взаимодействие с водородом
В реакциях галогенов с водородом образуются газообразные галогеноводороды.
H2+F2=2HF - фтор взаимодействует с водородом со взрывом.
H2+Cl2=2HCl - смесь хлора с водородом взрывается только при поджигании или освещении.
H2+Br2 = 2HBr - бром начинает реагировать с водородом только при нагревании, и реакция происходит без взрыва.
H2+I2 = 2HI - реакция иода с водородом идёт медленно даже при нагревании.
-Теперь давайте рассмотрим пример такого взаимодействия. Желающие к доске…
(1 ученик пишет на доске, остальные в тетради)

- Исходя из этих реакций, скажите, как изменяется химическая активность веществ в ряду F2→ Cl2 →Br2 →I2 ? (Снижается)
- Все галогеноводороды хорошо растворяются в воде. Их растворы представляют собой кислоты:
HF — плавиковая, HCl — соляная, HBr — бромоводородная, HI — иодоводородная.
Б) С другими неметаллами
С кислородом взаимодействует только фтор, образуя соединение диоксидифторид
F2 + О2 = О2F2
Хлор и бром реагируют со всеми неметаллами, кроме азота и кислорода.
- Посмотрим, как взаимодействую галогены с неметаллами на примере взаимодействия Хлора с фосфором. В результате такой реакции возможно образование солей, в которых фосфор проявляет степени окисления +3 и +5. В данном случае рассмотрим образование продукта с валентностью фосфора (III). К доске пойдет…
(1 ученик у доски, остальные у себя в тетради)
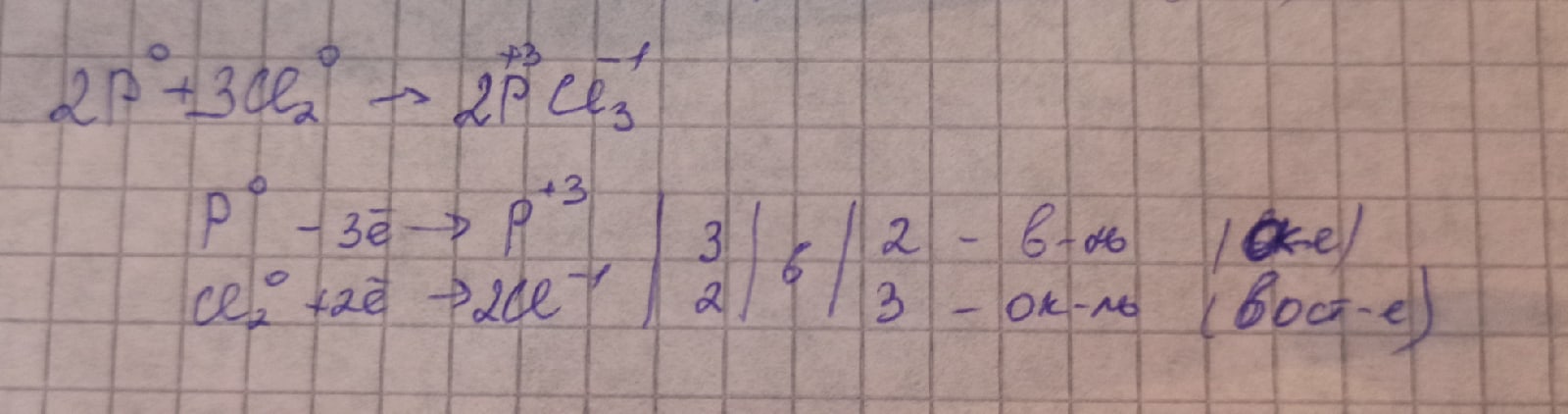
3) Bытеснение галогенами друг друга из растворов солей
- На прошлом уроке мы с вами рассматривали способы получения галогенов и говорили, что для этого используют реакции их замещения в растворах солей.
-Какого правила придерживаемся при осуществлении этого замещения? (Более активный галоген вытесняет менее активный из раствора его соли)
-Как думаете, хлор вытеснит бром из раствора его соли? (да) Почему? (потому что он активнее)
А йод вытеснит хлор? (нет) Почему? (потому что он менее активный, чем хлор)
- А теперь рассмотрим данное свойство галогенов на примере взаимодействия хлора с бромидом натрия. К доске пойдет…
(1 ученик у доски, остальные в тетради)
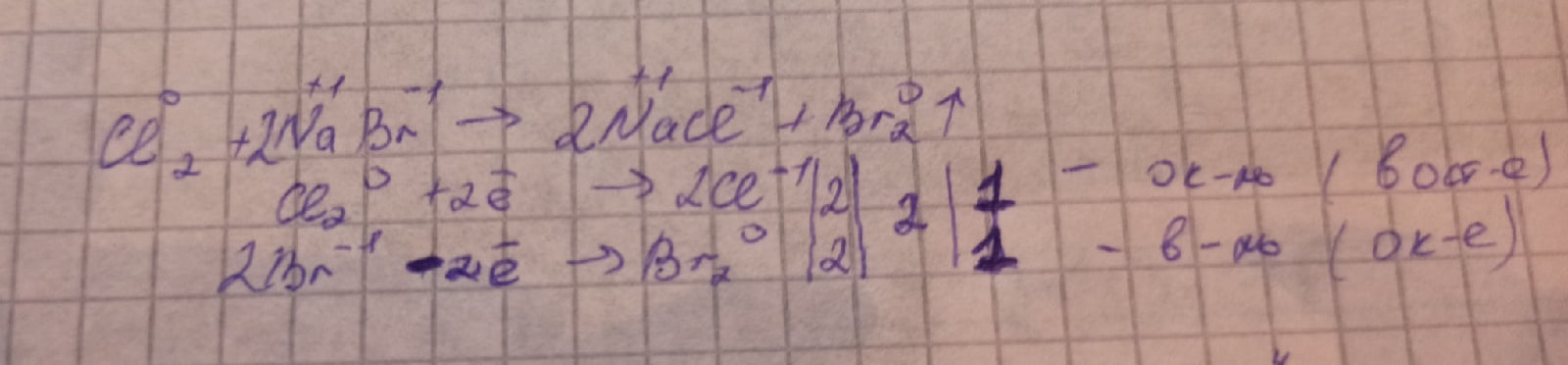
4) Взаимодействие галогенов с водой
Фтор не вытесняет галогены из растворов солей, т.к. взаимодействует с водой, вытесняя из нее кислород:
2F2 + 2H2O = 4HF + O2
(1 ученик у доски, другие в своей тетради)
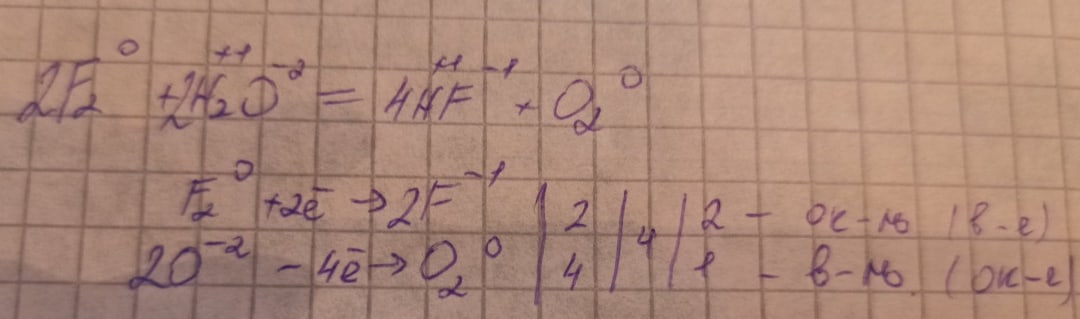
Хлор взаимодействует с водой с образованием двух кислот:
(пишу у доски сама, задавая детям вопросы)

- Как думаете, какие кислоты можем получить? (соляную точно назовут)
- Определим степени окисления элементов и их изменение в данной реакции. Какой элемент меняет свою степень окисления? (хлор). Изменяют ли степень окисления атомы других элементов? (нет)
- Верно, в данной реакции происходит самоокисление и самовосстановление хлора. Такая реакция носит название – диспропорционирование.
- Давайте запишем определение в тетрадь.
Диспропорционирование — химическая реакция, в которой один и тот же элемент выступает и в качестве окислителя, и в качестве восстановителя, причём в результате реакции образуются соединения, которые содержат один и тот же элемент в разных степенях окисления.
- Состав продуктов взаимодействия хлора с водой зависит от температуры. Уравнение реакции хлора с горячей водой вы самостоятельно составите дома.
5. Взаимодействие галогенов с щелочами.
-Также галогены диспропорционируют в растворах щелочей. Данная реакция подобна реакции с водой.
-А теперь рассмотрим данное свойство галогенов на примере взаимодействия хлора с гидроксидом калия при разных условиях. К доске пойдет…
(1 ученик у доски, остальные в тетради)

IV. Закрепление знаний
- Давайте проверим, как вы усвоили материал следующим образом.
1 вариант пишет реакции взаимодействия Брома с веществами: Na, P.
2 вариант пишет реакции взаимодействия Фтора с веществами: Si, H2.
3 вариант пишет реакции взаимодействия Йода с веществами: Li, Si
V. Домашнее задание.
Составить уравнение окислительно-восстановительных реакций, используя метод электронного баланса
Na+Cl2=
P+Cl2= (фосфор имеет валентность V)
Cl2+H2O (горячая)=
Cl2+ NaI=